研究确定了多跨膜蛋白折叠和组装的新拓扑发生途径
发布时间:2024-05-18 10:32:17 编辑:尚纪堂 来源:
中国科学院上海有机化学研究所张在荣研究员领导的研究人员发现了多跨膜蛋白(MSP)折叠和组装的翻译后拓扑发生途径。
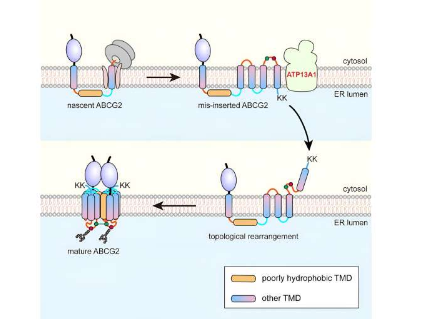
人类细胞内质网(ER)膜上合成的大约5,000种膜蛋白中,超过一半是MSP,它们在细胞和生物体生理学中发挥着关键作用,充当离子通道、转运蛋白、受体和膜内酶。
这些功能的很大一部分依赖于极性和带电氨基酸,导致形成疏水性差的TMD(pTMD)。然而,pTMD面临着被Sec61易位子识别并整合到磷脂双层中的挑战,Sec61易位子更喜欢疏水性TMD。
在人类蛋白质组中,大约30%的膜蛋白和超过50%的MSP至少含有一种pTMD。如何有效识别这些pTMD并精确包装成成熟的MSP结构一直是一个重大科学问题。
以六跨蛋白三磷酸腺苷结合盒转运蛋白G2(ABCG2)为模型,研究人员发现,在共翻译易位过程中,ABCG2的pTMD2穿过易位子的中心孔进入内质网腔,而不是整合到内质网腔中。磷脂双层通过易位子的侧门。
这导致下游TMD以相反的方向插入ER膜中,从而形成独特的中间体。随着C端带正电荷的双赖氨酸残基的翻译,发生近乎全局的拓扑重排过程。
亲和纯化表明ATP13A1可以检测ABCG2的C端正电荷信号。用带负电荷或中性氨基酸替换赖氨酸残基可显着减弱ATP13A1和ABCG2突变体之间的相互作用。
此外,敲除ATP13A1会导致错误折叠的ABCG2构象明显积累,主要是内质网膜内TMD6的错误折叠构象。因此,ATP13A1在MSP的拓扑发生中起着至关重要的作用,其中它的ATP酶活性促进了错误定向的TMD6从脂质双层错位到细胞质中。
随后,胞质TMD6重新整合到ER膜中,从而驱动其他上游TMD的翻译后拓扑重排。
TMD4-6成功重排后,中间体可以寡聚成四级结构。这个过程可能促进pTMD2从水性ER腔整合到最终结构中,并整合到被周围TMD紧密包裹的成熟结构中。
总之,这项现已发表在《分子细胞》杂志上的研究解释了“困难”的pTMD如何通过共翻译方式跳过插入,并在折叠后期翻译后埋入最终的正确结构中,从而避免过多的脂质暴露。
值得注意的是,由于ABCG2拓扑发生过程中pTMD2暴露于内质网腔,ABCG2-S441N基因突变引起的N441糖基化修饰可以显着阻断拓扑发生后期pTMD的组装。由于ABCG2是一种尿酸转运蛋白,这项研究解释了这种突变如何与痛风和高尿酸血症等人类疾病密切相关。
