药物结构单元的一步合成抗迈克尔反应的新方法
1887 年,化学家亚瑟·迈克尔爵士报道了 α,β- 不饱和羰基化合物 β 位上的亲核加成反应。这些反应被称为迈克尔加成反应,至今已得到广泛研究。相比之下,反迈克尔加成反应(指 α 位上的亲核加成反应)一直难以实现。这是因为 β 位的亲电性比 α 位高。
过去克服这些困难的尝试主要有两种方法。第一种方法是通过分子内反应来限制加成位置,第二种方法是在β位引入强吸电子基团。然而,这些方法对于通过反迈克尔反应合成复杂分子并不理想。
在一项新研究中,由日本东京理科大学应用化学系的 Takanori Matsuda 教授领导、包括 Ryota Moro 在内的全球研究团队,以及来自日本福井大学创新研究终身制项目的助理教授 Hirotsugu Suzuki,成功实现了丙烯酰胺的钯催化反迈克尔加成反应。这是反迈克尔型加成反应的第一个例子。
“我们发现,催化量的三氟乙酸钯(II)Pd(TFA) 2能够促进吲哚与丙烯酰胺以氨基喹啉基团为导向基团进行反迈克尔加成反应,从而高产率地生成加成产物,”Matsuda 教授解释道。
该研究发表在《美国化学会志》上。
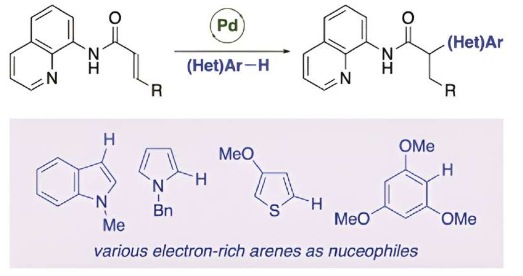
研究团队推测,在 α,β-不饱和羰基化合物中引入导向基团,可以稳定反应中间体,从而促进反迈克尔型加成反应。为了验证这一点,研究人员首先使用具有氨基喹啉导向基团的丙烯酰胺和亲核试剂 1-甲基吲哚作为模型底物,研究在钯催化剂存在下的反迈克尔型加成反应。
此反应目标产物的产率为90%,在2毫摩尔的反应规模下,没有出现产率损失,表明该反应具有实用性。
该反应也适用于β-取代的肉桂酰胺衍生物和带有烷基的巴豆酰胺衍生物。此外,该反应可与多种亲核试剂顺利进行,包括许多吲哚、杂环化合物(如吡咯和噻吩)以及富电子芳香族化合物。
此外,该反应中使用的氨基喹啉引导基团可以转化为羧酸和其他酰胺,这表明该反应的实用性。
研究人员还通过标记实验研究了该反应的机理。他们发现,最初丙烯酰胺与 Pd(TFA) 2配位,形成五元环钯中间体。然后反应进行,吲哚对中间体进行亲核攻击,生成烷基钯物质。最后,酸除去钯并再生 Pd(TFA) 2,生成所需的 α-取代羰基化合物。
铃木博士强调了这项研究的潜在应用,他说:“反迈克尔型加成有望成为理想的一步反应,原子效率达 100%,用于合成常用于药物的 α 取代羰基化合物。我们的方法将使该反应得到广泛应用。”
总的来说,这种新方法可以高效、可持续地合成α-取代羰基化合物,从而合成药物和其他有机化合物。
免责声明:本答案或内容为用户上传,不代表本网观点。其原创性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本站不作任何保证或承诺,请读者仅作参考,并请自行核实相关内容。 如遇侵权请及时联系本站删除。
